Das BRUNIE|ERP -System als geeignete Software zur Herstellung, dem Handel und der Aufbereitung nach MDR*.
*Medical Device Regulation MDR – Medizinprodukteverordnung (2017/745)
✓ Qualitätsmanagement
✓ Risikomanagement zum Produkt
✓ Validierung der Produktionsprozesse
✓ Validierung der ERP-Software (DIN EN:13485)
✓ Produktfreigabe und Leistungsprüfung
✓ Meldung zu Vorkommnissen von Produkten
✓ Rückverfolgbarkeit
✓ Überwachung nach dem Inverkehrbringen
Die Einhaltung der MDR stellt für viele eine große Herausforderung dar. Anhand einiger Beispiele zeigen wir, wie eine konforme Umsetzung in unserem ERP-System möglich ist. Hier werden unter anderem wichtige Anforderungen in digitaler Form realisiert, deren analoge Umsetzung unmöglich geworden ist. Dies ist nur möglich, da das BRUNIE|ERP-System umfangreiche Zweige eines Unternehmens in einer Datenbank zusammenfasst, wie zum Beispiel WW, PP, HR, FI, QM, QS und einiges mehr.
Beispiele aus der MDR und deren Umsetzung:
Verordnung (EU) 2017/745
(32)
Um sicherzustellen, dass serienmäßig hergestellte Produkte den Anforderungen dieser Verordnung jederzeit entsprechen und dass die Erfahrungen, die im Zuge der Verwendung der hergestellten Produkte gesammelt werden, in das Herstellungsverfahren einfließen, sollten alle Hersteller über ein Qualitätsmanagementsystem und ein System zur Überwachung nach dem Inverkehrbringen verfügen, das der Risikoklasse und der Art des betreffenden Produkts angepasst sein sollte. Zur Minimierung des Risikos bzw. um Vorkommnisse im Zusammenhang mit Produkten zu verhindern, sollten die Hersteller des Weiteren ein Risikomanagementsystem und ein System für die Meldung von Vorkommnissen und Sicherheitskorrekturmaßnahmen im Feld einrichten.
Lösung ERP - System
Reklamationsmodul:
Nach dem Inverkehrbringen übernimmt das ERP-System zentral die Verwaltung gemeldeter Beanstandungen und Fehler. Durch ein klar definiertes Rollensystem werden die Meldungen gesetzeskonform bearbeitet.
Mit der Annahme der Meldung wird bereits durch das ERP-System der zuständige QMB informiert, um zeitnah eine Beurteilung zu gewährleisten.
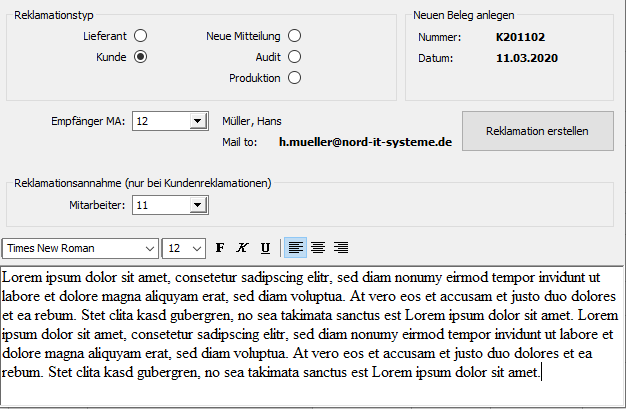
Aus der Bearbeitung ergeben sich über längere Zeiträume aussagekräftige Analysen zu den Produkten. Weiterhin erfolgt die Verwaltung meldepflichtiger Vorkommnisse.
Dabei werden alle Dokumente und Informationen zentral zusammengefasst und revisionssicher in der ERP – eigenen Akte gespeichert.
Ergeben sich Korrekturmaßnahmen aus einer Meldung, wird hierzu automatisiert eine CAPA angelegt.
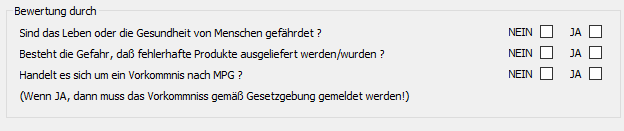
(Abb.: Bewertung durch den Sicherheitsbeauftragten)
Korrektur- und Vorbeugemaßnahmenmodul:
Die CAPAs werden zentral in der Datenbank verwaltet. Entsprechende Aktionspläne können definiert, überwacht und das Ergebnis kontrolliert werden. Ebenfalls ist die Langzeitwirksamkeitsüberwachung integriert.
Verordnung (EU) 2017/745
(34)
Die Überwachung und Kontrolle der Herstellung von Produkten, ihre Überwachung nach dem Inverkehrbringen und die mit ihnen verbundenen Vigilanzaktivitäten sollten durch eine der Organisation des Herstellers angehörende, für die Einhaltung der Regulierungsvorschriften verantwortliche Person erfolgen, die über bestimmte Mindestqualifikationen verfügt.
Lösung ERP - System
Produktionsprozess:
Zur Überwachung und Kontrolle der Herstellung von Produkten, sind entsprechende Elemente in dem ERP-System vorhanden.
Hierzu zählt unter anderem der QS-Arbeitsplatz, der die produzierte Ware kontrolliert.
Dadurch können durch den Kundenservice und den Warenausgang nur Produkte geliefert werden, die zuvor durch die QS freigegeben wurden.
Durch das Element werden weiterhin dem Qualitätsmanagement Daten zur Ausschussquote, Daten über Fehler sowie weitere produktabhängige Messdaten aus der Produktion bereitgestellt.
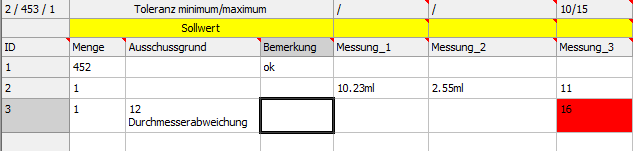
(Abb.: Erfassung von Qualitätsdaten in der Endkontrolle)
Durch die Integration des Personals mit Schulungsüberwachung, Qualifikationsverwaltung und Rechteverwaltung erfolgt eine automatische Kontrolle der Personalqualifikation.

(Abb.: Qualifikationskontrolle des Mitarbeiters)
Verordnung (EU) 2017/745
(42)
Das UDI-System sollte für alle in Verkehr gebrachten Produkte mit Ausnahme von Sonderanfertigungen gelten und auf international anerkannten Grundsätzen einschließlich Begriffsbestimmungen basieren, die mit den von den wichtigsten Handelspartnern verwendeten kompatibel sind. Damit das UDI-System rechtzeitig für die Anwendung dieser Verordnung einsatzbereit ist, sollten in dieser Verordnung detaillierte Vorschriften festgelegt werden.
Lösung ERP - System
UDI - Produktkennzeichnung:
Die Produktauszeichnung sowie aller dazugehörigen Verpackungsstufen war schon immer Bestandteil des ERP-Systems. Durch die integrierte Lösung konnte es zu keiner Übertragungsabweichung von Daten kommen. Die Produktkennzeichnung wird damit immer nach den einmalig spezifizierten Artikeldaten, unveränderlich, vorgenommen. Gleiches gilt für angeschlossene Drucksysteme.
Automatisch werden alle Ausdrucke zum Produktionsauftrag gespeichert und lassen sich jederzeit, mit den Druckdaten, nachvollziehen.
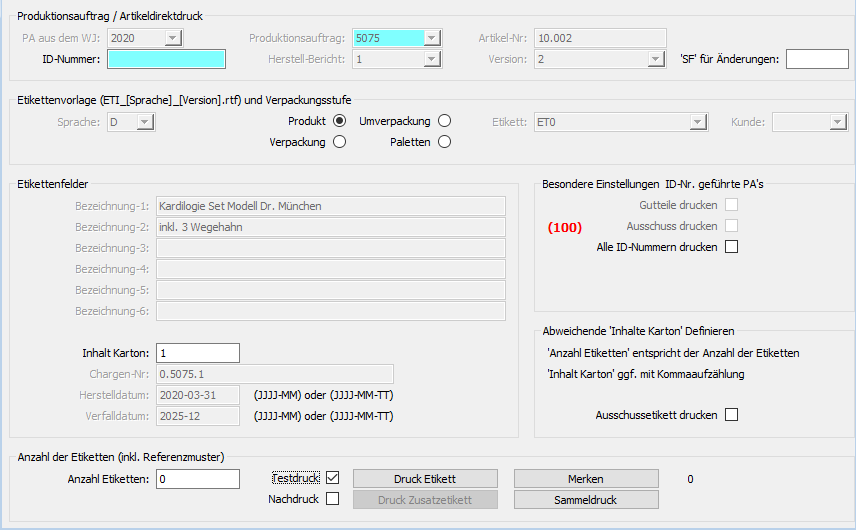
(Abb.: Erfassung von Qualitätsdaten in der Endkontrolle)
Die verpflichtende UDI für Medizinprodukte ist integriert in die Produktauszeichnung. Die Daten werden ohne manuellen Eingriff bereitgestellt. Somit ist ein unveränderlicher, automatisch erzeugter UDI für die Produkte sichergestellt.
Alle UDI Informationen werden in der Datenbank zentral gespeichert und stehen für den Upload auf die EUDAMED Datenbank bereit.

(Abb.:HIBC - Beispielcode)
Alle gängigen Normen (GS1, HIBC) werden unterstützt.
Verordnung (EU) 2017/745
(42)
Artikel 14
Allgemeine Pflichten der Händler
(1) Wenn die Händler ein Produkt auf dem Markt bereitstellen, berücksichtigen sie im Rahmen ihrer Tätigkeiten die geltenden Anforderungen mit der gebührenden Sorgfalt.
(2) Bevor sie ein Produkt auf dem Markt bereitstellen, überprüfen die Händler, ob alle folgenden Anforderungen erfüllt sind:
a) Das Produkt trägt die CE-Kennzeichnung, und es wurde eine EU-Konformitätserklärung für das Produkt ausgestellt; geltenden Anforderungen mit der gebührenden Sorgfalt.
b) dem Produkt liegen die vom Hersteller gemäß Artikel 10 Absatz 11 bereitgestellten Informationen bei;
c) bei importierten Produkten hat der Importeur die in Artikel 13 Absatz 3 genannten Anforderungen erfüllt;
d) gegebenenfalls wurde vom Hersteller eine UDI vergeben.
Zur Erfüllung der Anforderungen nach UnterAbsatz 1 Buchstaben a, b und d kann der Händler ein Probenahmeverfahren anwenden, das für die von ihm gelieferten Produkte repräsentativ ist.
Lösung ERP - System
Konformitätserklärungen und Überwachung:
Als Hersteller übernimmt das ERP-System die Erstellung LOT-bezogener Konformitätserklärungen oder die Erstellung laufzeitgebundener Langzeiterklärungen.
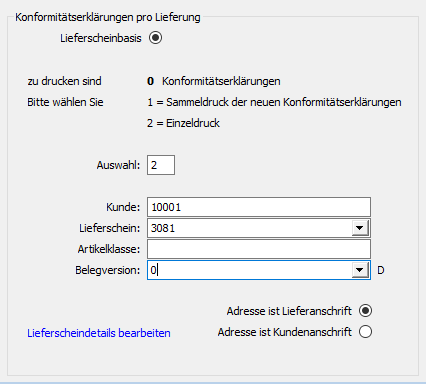
(Abb.:Erstellung LOT bezogener Konformitätserklärungen)
Als Händler unterstützt das ERP-System die Verwaltung des Artikelstamms, die Kontrolle der erhaltenen Konformitätserklärungen sowie deren Verlängerungen. Somit wird vermieden, dass nicht zulässige Produkte nach MDR an den Endverbraucher versendet werden können.
Validierung des ERP-Systems:
ISO 13485:2016
Im Kapitel 4.1 der ISO 13485:2016 ausdrücklich: Software, die im Rahmen des Qualitätsmanagementsystems eingesetzt wird, muss validiert werden.
Lösung ERP - System
Aufgrund der Nutzung von entsprechenden Modulen des ERP-Systems für das Qualitätsmanagement müssen diese Module validiert werden. Hierzu wurde eine Standardvalidierung durch unser Qualitätsmanagement erstellt, die auf einer empfohlenen Standardkonfiguration für Medizinproduktehersteller und Händler beruht. Die Standardvalidierung wird auf das individualisierte Kundensystem übertragen und angepasst. Die Validierung wird kontinuierlich im Rahmen der Produktweiterentwicklung aktualisiert und erweitert. Weiterhin besteht ein Changemanagement für unsere Kunden, durch das der valide Zustands Ihres Produktivsystems aufrechterhalten wird, ohne das Gesamtsystem neu zu validieren. Dadurch sind weiterhin regelmäßige Updates möglich
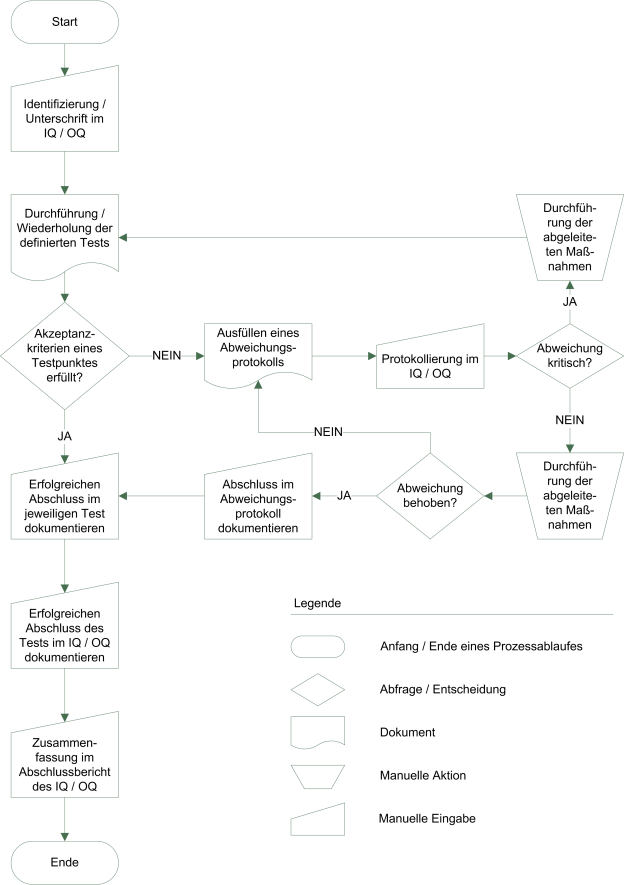
Damit das validierte Kundensystem aufrechterhalten wird, entwickelt die nord-IT-systeme unter strengen Qualitätsrichtlinien.
